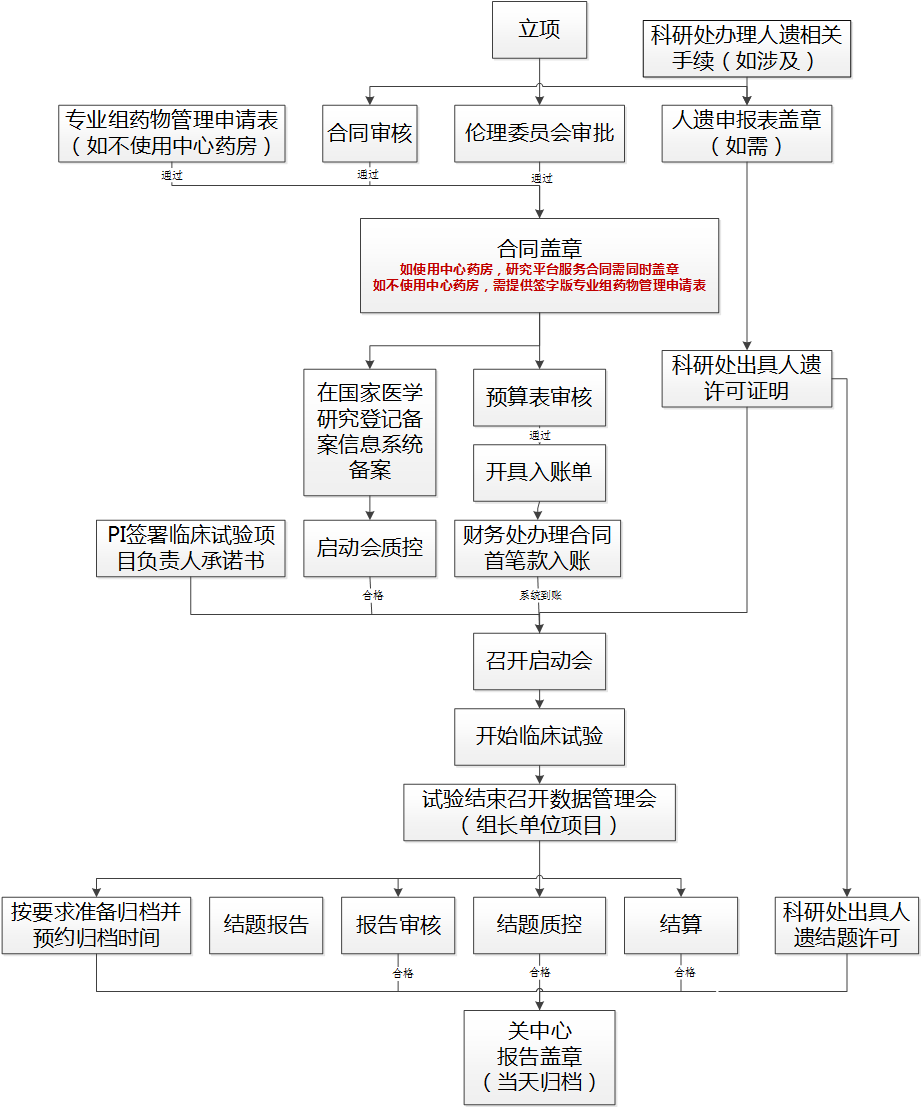
流程图(2023年1月4日更新):
2023年启动各环节平均时长

流程说明(按具体工作整理,请仔细阅读PDF文件)
立项前须知.pdf(2023年9月27日更新)-北京协和医院机构伦理参会邀请模板
伦理委员会审查流程及注意事项.pdf(2025年6月27日更新)
新项目立项.pdf(2025年3月20日更新)-财务相关信息、研究者简历模板、利益冲突声明(申办者)、利益冲突声明(研究者)、研究团队名单
新项目审查须知—药物 (2025年3月20日更新)-申办者申报资料的真实性声明
新项目审查须知—医疗器械/体外诊断试剂 (2025年3月20日更新)
新项目审查须知—标本测定/数据处理 (2025年3月20日更新)
新项目审查须知—国家创新药临床试验项目申请工作指引(拟申请30天通道试验项目)(2026年1月12日新增)附件1 国家创新药临床试验项目申请表(拟申请30天通道试验项目)、附件2 北京协和医院创新药临床试验项目初始审查申请指南(拟申请30天通道试验项目)
人遗申报表盖章.pdf (2025年6月20日更新)
会议审查准备工作.pdf(2025年6月27日更新)-北京协和医院药物临床试验伦理委员会会议审查主要研究者请假函
方案知情修正案、项目复审文件递交.pdf(2025年6月27日更新)
修正案审查申请指南 (2024年6月12日更新)
复审申请指南 (2024年6月12日更新)
机构文件递交.pdf(2026年3月2日更新)-全款预算表/费用汇总表、赔偿承诺书
签署合同须知(2025年12月2日更新,合同模板详见下载专区)
主合同审核关注要点 (2024年6月5日更新)
办理入账.pdf(2026年01月21日更新)
研究助理管理.pdf (2025年6月27日更新)-研究助理备案登记表
试验药物管理.pdf(2025年9月1日更新)-专业组药物管理申请表
项目启动.pdf(2025年6月19日更新)
召开启动会注意事项 (2025年6月19日更新)
年度跟踪审查报告.pdf(2025年6月27日更新)-药物临床试验项目年度定期跟踪审查报告
临床试验安全性信息报告.pdf(2024年3月22日更新)-SAE报告表模板、北京协和医院药物临床试验机构文件递交信
临床试验中的方案违背报告.pdf (2025年8月5日更新)-方案违背/偏离报告模板
其他伦理文件递交.pdf(2024年3月22日更新)-结题报告模板
质量控制.pdf (2024年6月21日更新)
项目结算.pdf(2023年9月28日更新)-临床试验合同结算表.xlsx、临床试验合同结算表.pdf、无需退款说明、退款说明
归档、报告盖章及关中心.pdf(2025年7月23日更新)-档案移交表(药物)、档案移交表(医疗器械、体外诊断试剂)、诚信承诺书、北京协和医院实验室参考范围(实验室负责人签字日期:2025.05.16)、既往实验室正常值范围详见下载专区
临床试验现场检查.pdf (2022年6月10日更新)
















