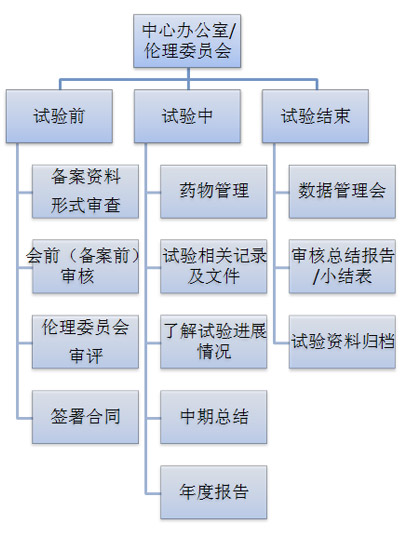
质量控制体系:
药物临床试验质控体系:由中心办公室、中心质控小组、专业组领导小组、主要研究者共同组成,在药物临床试验的不同阶段对质量进行控制和监督。
质量控制:
1.机构必须对专业负责人进行资格审核。负责多中心研究时,必须对各中心专业负责人进行资格审核。
专业负责人必须了解并熟悉试验药物的性质、作用、疗效及安全性(包括该药物临床前研究的有关资料),有能力设计或修改药物临床试验方案;同时也应掌握临床试验进行期间发现的所有与该药物有关的新信息。2.专业负责人负责成立研究小组,培训相关人员,内容包括GCP、SOP、研究方案,须向参加临床试验的所有工作人员说明有关试验的资料、规定和职责,确保有足够数量并符合试验方案的受试者进入临床试验。
3.制定SOP。专业负责人本人或本专业从事过临床试验的专业人员根据试验药物特点,制定、修订或重新制定SOP,机构负责人审查是否执行。SOP应视为药物研究内部规定,研究的全过程必须按SOP执行,违背SOP的任何指令,研究人员有权拒绝执行。
4.机构质控小组随时监查研究人员是否按照研究方案及SOP执行研究,对严重违背方案和SOP或坚持不改者,有权终止其研究资格。
质量控制运行: