一、项目要求
Ø 纳入30日通道的药物临床试验
Ø 计划进行新药研究申请,具备在获得药物临床试验批准通知书后12周内完成启动(签署首例知情同意书)的条件。
二、递交流程
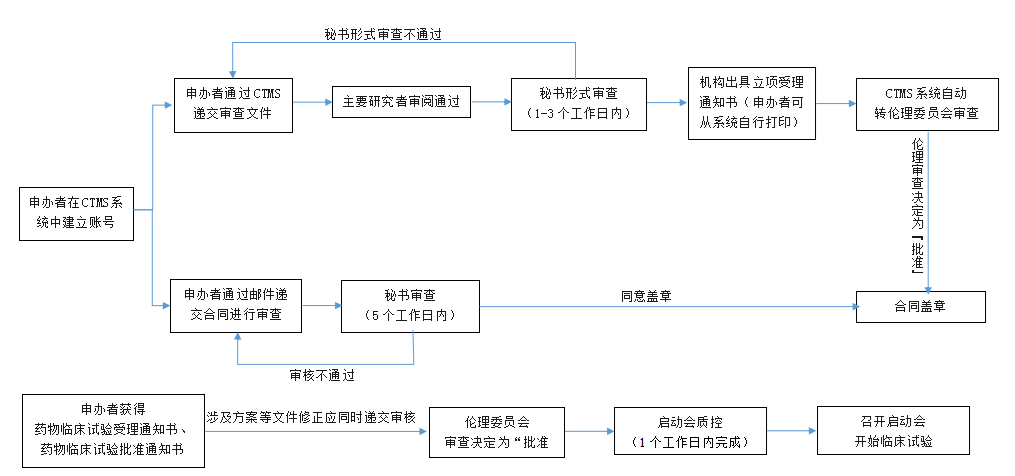
1. 申办者需填写国家创新药临床试验项目申请表(见附件1),按照《中国医学科学院北京协和医院药物临床试验伦理委员会国家创新药临床试验项目初始审查申请指南》(附件2)在CTMS系统递交的初始审查资料中递交资料。
2. PI在系统中审阅后提交后,机构进行形式审查,在1-3个工作日内给予立项审查回复,形式审查通过后出具机构立项受理通知书,系统自动转伦理委员会审查,可通过系统中打印机构立项受理通知书。
3. 在递交立项初始审查资料的同时可递交合同进行审核,机构在5个工作日内回复合同审核意见。伦理委员会审查决定为“批准”时,可签署临床试验合同。
4. 申办者在获得药物临床试验批准通知书后应及时将药物临床试验受理通知书和药物临床试验批准通知书上传至CTMS系统,如涉及方案等文件的修正也应同时递交审核。
5. 申办者在获得伦理委员会批准后应及时在国家药品监督管理局药品审评中心和国家医学研究登记备案平台完成备案,预约机构启动会质控,质控组在1个工作日内完成启动会质控。
6. 启动会质控通过后即可召开启动会开始试验。
国家创新药临床试验项目递交流程图
附件1 国家创新药临床试验项目申请表(拟申请30天通道试验项目)
附件2 北京协和医院创新药临床试验项目初始审查申请指南(拟申请30天通道试验项目)
















