近日,北京协和医院风湿免疫科李梦涛主任团队,联合浙江大学杨隽研究员团队,共同揭示了Activin A/ALK4信号通路在Th17细胞和肺血管内皮细胞的双重作用机制,为红斑狼疮相关肺动脉高压的治疗提供了新靶点。该研究成果发表在国际知名期刊Arthritis & Rheumatology上。

肺动脉高压(PAH)是系统性红斑狼疮(SLE)的严重并发症及主要死因之一。现有治疗方案主要为肺血管扩张药物,但难以从根本阻断甚至逆转疾病核心进程。深入揭示红斑狼疮相关肺动脉高压(SLE-PAH)的发病机制,寻找精准干预靶点,是改善患者预后的关键突破口。
基于这一迫切临床需求,研究团队首先运用质谱流式细胞术,精细比对SLE-PAH患者治疗前后的免疫细胞动态。研究者发现,治疗后患者外周血中的CD4⁺ T细胞显著减少。进一步流式分析揭示,患者外周血中促炎性的Th17细胞比例异常升高。血清学检测发现,SLE-PAH患者的IL-17和Activin A水平显著高于单纯SLE患者及健康人,且其升高程度与肺动脉高压的核心临床指标呈现强相关性,为致病假说提供了重要线索。
研究团队构建了CD4⁺ T细胞清除的小鼠低氧模型。结果证实清除CD4⁺ T细胞可有效抑制肺动脉压升高,但无法逆转已形成的肺血管结构重塑,明确了CD4⁺ T细胞在肺动脉高压发生中的驱动角色及其作用的局限性。
研究人员进一步设计了Th17细胞与肺血管内皮细胞共培养体系。研究发现,当Th17细胞过表达Activin A的受体ALK4时,可强力诱导内皮细胞发生内皮-间质转化,这是肺血管重塑的核心病理过程。
通过构建ALK4过表达的SLE-PAH小鼠模型,研究团队发现,Activin A通过其受体ALK4在Th17细胞和肺血管内皮细胞中发挥“双重致病作用”,既加剧炎症反应,又直接驱动血管结构破坏,共同促进SLE-PAH的发生发展。这一成果为后续研究和临床干预提供了重要理论基础。
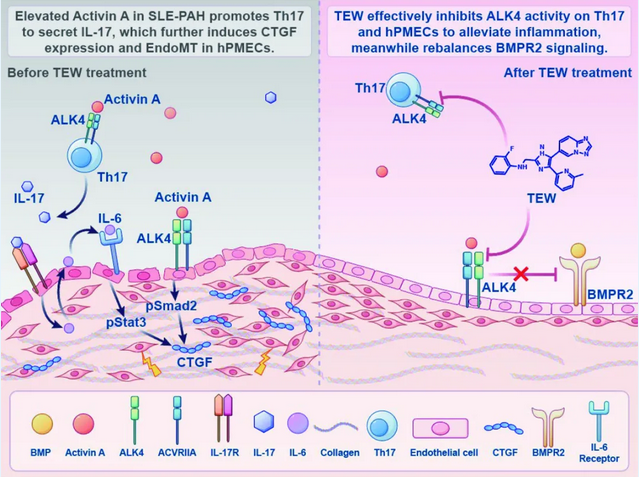
本研究探索了SLE-PAH的又一新发病机制,揭示了Activin A/ALK4信号通路在SLE-PAH中的核心作用及独特双靶点机制,为理解结缔组织病相关PAH的发病机制提供了新视角。针对该通路的干预策略,有望同时抑制过度免疫反应和阻断血管结构重塑,达到“一石二鸟”的效果,从而突破当前治疗瓶颈,显著改善患者预后。
浙江大学基础医学院生理学系、浙江大学医学院附属第二医院经血管植入器械全国重点实验室杨隽研究员、北京协和医院风湿免疫科主任李梦涛为本文共同通讯作者,浙江大学基础医学院生理学系景书亮和北京协和医院风湿免疫科钱君岩主治医师为本文第一作者。
文图 / 风湿免疫科
编辑 / 傅谭娉 陈恔
















