近日,北京协和医院院长张抒扬、药物研发与评价平台主任栾晓东联合中国医学科学院基础医学研究所陈厚早研究员团队,通过冷冻电镜技术解析了短链烯酰辅酶A水合酶(ECHS1)底物识别机制,本研究为了解ECHS1在脂肪酸代谢中的作用及其与疾病的关系提供了重要理论基础。该研究成果发表在国际知名期刊Communications Biology上。

ECHS1是参与脂肪酸β-氧化途径的关键线粒体酶,对细胞内的脂肪酸代谢和能量产生至关重要。ECHS1在异亮氨酸和缬氨酸的分解代谢中同样发挥着重要作用。这些代谢途径一旦出现异常,就会破坏丙酮酸脱氢酶复合体(PDC)和电子传递链,进而导致代谢和神经障碍。ECHS1缺乏症(ECHS1D)可导致继发性OXPHOS功能障碍,ECHS1D还与多种疾病特别是心肌病密切相关。深入研究ECHS1的底物识别机制,对于揭示这些疾病的发病机制、开发新的治疗方法具有重要意义。但对于ECHS1如何识别不同的酰基辅酶A(acyl-CoA)底物,以及这一识别机制如何影响其生理功能,研究仍处于空白。
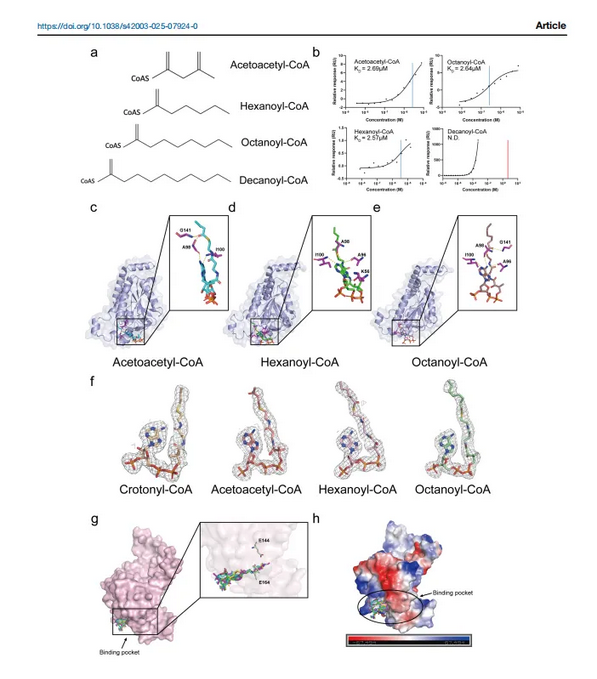
本研究中,研究人员采用冷冻电镜技术,成功解析了ECHS1的无配体结构以及其与多种酰基辅酶A复合物的高分辨率结构。这些复合物包括ECHS1与巴豆酰辅酶A(crotonyl-CoA)、乙酰乙酰辅酶A(acetoacetyl-CoA)、己酰辅酶A(hexanoyl-CoA)和辛酰辅酶A(octanoyl-CoA)分别结合的结合体。
研究发现,ECHS1识别底物的机制随着酰基辅酶A的脂肪酸链长度的不同而有所变化。具体来说,ECHS1与巴豆酰辅酶A的结合最为紧密,表现出最高的酶活性。而对于其他酰基辅酶A,虽然它们也能与ECHS1结合形成复合物,但酶活性显著降低,甚至无活性。
研究还发现,ECHS1上的关键氨基酸突变会显著影响其底物识别能力和酶活性。这些突变不仅包括与底物形成氢键和疏水相互作用的氨基酸,还包括与底物形成盐桥的氨基酸。这些发现为了解ECHS1的功能机制提供了新的视角。
本研究首次从结构和生化角度系统阐述了ECHS1的底物识别机制,揭示了ECHS1如何根据酰基辅酶A的脂肪酸链长度选择性地催化底物。同时,研究还揭示了关键氨基酸突变对ECHS1功能的影响,为理解ECHS1缺陷相关疾病的发病机制提供了重要线索。
▲ECHS1识别不同脂肪酸链长度酰基辅酶A的机制探究
该成果对于临床诊断和治疗ECHS1缺陷相关疾病具有重要意义。通过了解ECHS1的底物识别机制,医生可以更准确地判断患者是否存在ECHS1功能障碍,从而制定更有效的治疗方案。研究发现的关键氨基酸突变位点,为基因诊断和遗传咨询提供了重要靶标。栾晓东表示,基于这些发现,研究人员有望开发出针对ECHS1缺陷的新药,为患者带来新的治疗希望。
原文链接:https://www.nature.com/articles/s42003-025-07924-0
文字/栾晓东 陈恔
图片/栾晓东提供
编辑/王敬霞
















